| Saúde |
Proteínas modificadas no pulmão podem dar pistas sobre funções biológicas do bromo
A matriz extracelular é uma rede intrincada composta por um conjunto de macromoléculas que une e fixa as células para formar os tecidos, desempenhando funções vitais de suporte celular, comunicação intercelular e regulação do desenvolvimento tecidual.
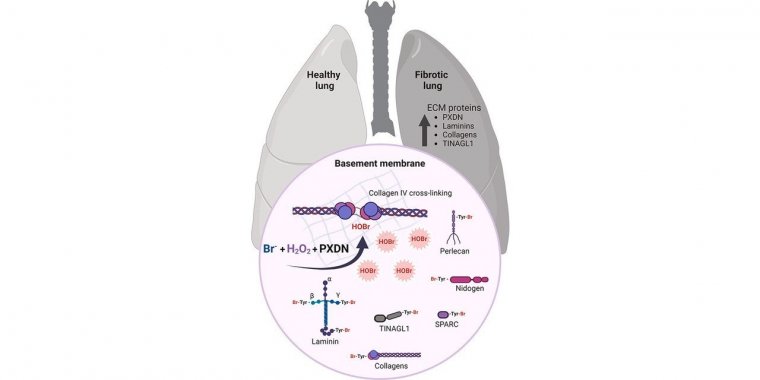
O grupo avaliou a presença de proteínas modificadas por bromotirosina em tecidos pulmonares obtidos de seres humanos saudáveis e de pacientes com fibrose pulmonar idiopática. Imagem: divulgação
Em estudo, pesquisadores identificaram proteínas da matriz extracelular modificadas pela ação do ácido hipobromoso em tecidos pulmonares com fibrose e em tecidos normais, sugerindo um possível papel fisiológico para a bromação de proteínas.
“Este trabalho mostrou que a bromação é encontrada fisiologicamente e que a peroxidasina, a enzima que catalisa a formação do ácido hipobromoso, tem outros alvos além do colágeno, o que era uma das grandes perguntas da área”, conta a pesquisadora Litiele Cezar Cruz, primeira autora do artigo. Ela realizou a pesquisa durante seu pós-doutorado, sob a supervisão da professora Flávia Meotti, do IQ-USP e do Redoxoma.
A halogenação é uma reação química na qual um átomo de halogênio – principalmente flúor, cloro, bromo ou iodo – é incorporado a uma molécula.
As modificações halogênicas de moléculas biológicas são cada vez mais reconhecidas em várias áreas da biologia, mas sua relevância no organismo de mamíferos ainda é pouco estudada.
O papel do íon brometo na formação oxidativa da ligação cruzada entre moléculas de colágeno do tipo 4 na matriz extracelular foi a primeira evidência de que o bromo exerce um papel essencial em organismos vivos.
“Conhecemos mais sobre clorinação, modificação que depende da mieloperoxidase, uma enzima inflamatória. Em geral, esse tipo de halogenação associada a processos de doenças é mais estudado, porque a inflamação está na gênese da maioria das doenças. Em doenças inflamatórias com atividade da mieloperoxidase, a tendência é encontrarmos um aumento de proteínas com adição de cloro. Essa modificação pelo bromo é muito parecida, pois cloro e bromo são elementos químicos muito parecidos, e a alteração ocorre nos mesmos aminoácidos, incluindo a tirosina. Mas, embora a concentração de bromo no plasma seja mil vezes menor do que a de cloro, o cloro não é um bom substrato para a peroxidasina e, assim, na matriz extracelular temos mais ácido hipobromoso do que o hipocloroso”, explica Meotti.
Para ampliar as descobertas, Cruz investigou a presença de proteínas modificadas por bromotirosina em tecidos pulmonares obtidos de seres humanos saudáveis e de pacientes com fibrose pulmonar idiopática. Ela também reanalisou dados de proteômica de tecido pulmonar publicados anteriormente.
Tanto nas amostras de tecidos preparados agora quanto nos dados publicados anteriormente, a pesquisadora encontrou modificações em várias proteínas da matriz extracelular, mesmo em pulmões saudáveis. (Agência FAPESP)
VOCÊ TAMBÉM PODE ESTAR INTERESSADO EM