| Saúde |
Teste permite detectar coinfecção por nova espécie de parasita em casos graves de leishmaniose visceral
Nos últimos anos, médicos e cientistas de regiões do Brasil onde a leishmaniose visceral (LV) é endêmica têm se deparado com cada vez mais casos de coinfecção por diferentes protozoários: Leishmania infantum e Crithidia.
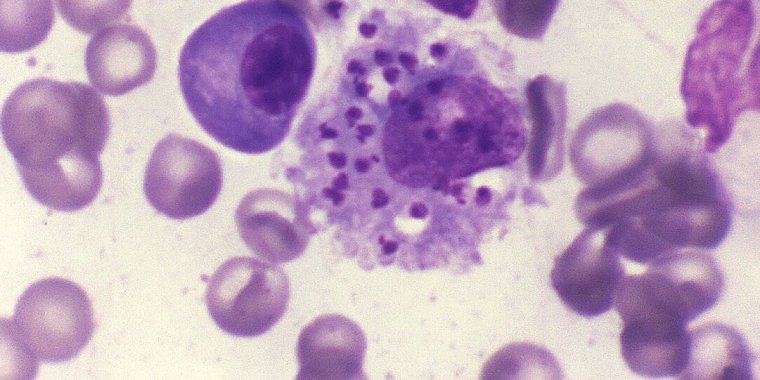
O protozoário Leishmania infantum, causador da leishmaniose visceral, pode afetar baço, medula óssea, fígado e gânglios linfáticos. Imagem: Francis W. Chandler/CDC/Wikimedia Commons
O diagnóstico preciso, no entanto, é dificultado pela ausência de testes simples e específicos.
Com o objetivo de acelerar e facilitar essa distinção e, consequentemente, a definição do tratamento, pesquisadores da Universidade Federal de São Carlos (UFSCar) desenvolveram um teste do tipo PCR (que analisa o material genético contido na amostra) que leva menos de duas horas para ser concluído.
O novo método representa um avanço no diagnóstico da LV – forma mais severa de leishmaniose que afeta órgãos como baço, medula óssea, fígado e gânglios linfáticos. Negligenciada, a doença é considerada um problema de saúde pública.
O estudo mostrou que o método foi altamente preciso na identificação e quantificação de L. infantum e Crithidia em amostras obtidas in vitro e in vivo ou coletadas de hospedeiros (humanos, cães, gatos e vetores), por exemplo, por meio de biópsias de pele ou aspirados de medula óssea.
“Apesar de já existirem outros métodos moleculares de identificação de espécies, eles costumam envolver o sequenciamento do DNA da amostra, processo mais trabalhoso, lento e custoso”, explica Sandra Regina Costa Maruyama, professora do Programa de Pós-Graduação em Genética Evolutiva e Biologia Molecular (PPGGEv) da UFSCar e coordenadora do estudo.
“Nosso teste avalia o material genético dos parasitas diretamente dos vetores e nos tecidos de pessoas e animais [gatos e cachorros].”
Ao contrário dos testes rápidos utilizados no sistema de saúde, que não detectam diretamente o parasita e sim os anticorpos produzidos contra ele, o novo ensaio quantitativo de PCR baseado em corante (qPCR) foi projetado e padronizado com sequências-alvo específicas para as espécies Leishmania infantum e Crithidia em amostras experimentais e clínicas.
Os novos alvos se mostraram específicos, entretanto é necessário realizar inicialmente um ensaio para detectar o primeiro parasita e, na sequência, um segundo para identificar Crithidia.
“Selecionamos esses novos alvos por meio de análises dos genomas das duas espécies. Agora que mostramos que apresentam especificidade em diferentes tipos de amostras, é necessário otimizar o ensaio para que em uma única reação de qPCR saibamos se a espécie infectante em questão é Leishmania infantum, Crithidia ou ambas”, diz Maruyama.
Atualmente, o grupo de pesquisa tem testado as amostras para deteção de L. infantum e, num segundo teste, faz a detecção de Crithidia.
Segundo a pesquisadora, qualquer laboratório de diagnóstico capacitado com equipamento de qPCR – que se tornou mais acessível durante a pandemia de COVID-19 – poderia realizar esse teste. A técnica pode ser útil para estudos epidemiológicos, monitoramento de carga parasitária e acompanhamento terapêutico. (Julia Moióli/Agência FAPESP)
VOCÊ TAMBÉM PODE ESTAR INTERESSADO EM